病院で、免疫抑制がかかった高齢者や疾患や治療の影響を受けているヒトでの多剤耐性菌の問題がときどきニュースになります。
院内感染させた病院に落ち度があるんじゃね?的事件報道指向な語りには疑問大ですが、もしもこのことを社会の危機ととらえて抜本的な対策をするならば、「その病院」だけを問題視してもしょうがない背景があります。
メディアやジャーナリストのみなさん、ぜひ世界における問題の背景に切り込むような取材や社会提言をしていただければと期待しております。
(業界や製薬会社のバリアは強固かもしれませんが〜)
感染管理系の皆さんも、視野を院内だけではなく地域における耐性菌伝播、グローバルな耐性菌伝播の話に眼を向けていく必要があります。
ライリー先生の講義 Lecture10: Molecular Epidemiology of healthcare-associated infectionsから。
医療関連のサーベイランスには下記のようなものがあります。
米国:National Nosocomial Infection Surveillance System(NNIS)
Replaced in 2005 by National Health Safety Network(NHSN) 400病院の規模だそうです。
EU: Hospital in Europe Links for Infection Control SUrveillance(HELICS)
European Center for Disease Prevention and Control(ECDC)
日本:Japan Nosocomial Infection Surveillance(JANIS) じゃにす、ですね。
International: International Nosocomial Infection Control Consortium Surveillance(NINCC)
薬剤耐性のサーベイランス
EU European Antimicrobial Resistance Surveillance Network (EARS-Net)
米国 National Healthcare Safety Network (NHSN)
ヒトが移動をしますので、国を超えて同じ菌やウイルスが把握されたりもします。
「病院」で特に問題になる病原菌
-----------------------------------------
Gram-positive bacterial pathogens (3 genera)
Staphylococcus spp: MRSA, CA-MRSA, Coagulase-negative SA
Enterococcus spp: VRE
Clostridium difficile
Gram-negative bacterial pathogens (>10 genera)
Enterobacteriaceae
Glucose non-fermenters
Enterobacteriaceae
E. coli
Klebsiella pneumoniae
Proteus spp
Enterobacter spp
Serratia spp
Citrobacter spp
Morganella spp
Providentia spp
Salmonella spp
Glucose non-fermentors
Pseudomonas aeruginosa
Acinetobacter baumanii
Stenotrophomonas maltophilia
Fungal agents
Candida spp
Aspergillus spp
Diarrheagenic E. coli, especially enteropathogenic E. coli (EPEC)
Hepatitis B, C
HIV
Mycobacterium tuberculosis
SARS virus (coronavirus)
Clostridium difficile Associated with use of broad-spectrum antibiotics
グラム陽性/陰性での特徴をみてみます。
GPB
More common in hospital infections
Limited number of species
Limited number of drug-resistance mechanisms
More new drugs available to treat drug-resistant strains
GNB
Increasing prevalence in hospitals and healthcare settings
Many species
Many mechanisms of drug resistance
Absence of new drugs to treat drug-resistant strains
--------------------------------------
下記はシンガポールの National University Health System, Division of Infectious Diseasesからの発表。
![]()
The Global Spread of Healthcare-Associated Multidrug-Resistant Bacteria: a Perspective from Asia.
Clin Infect Dis. 2013 Jan 18.
が、しかし。抗菌薬は「ヘルスケア関連」だけでつかわれているのではありません。
(話が横道にそれますが、横道といっていいのかはわかりません)
◆抗菌薬全体でみると、ヒトに使用されているのは総量の16%のみ
◆2010年、"29.1 million pounds"の抗菌薬のうち80%は食べ物関連で、17%は水に、3%は動物への注射として使用された
◆ノースカロライナの豚に使用された抗菌薬だけで、全米でヒトに使用された抗菌薬の使用量を上回る
日本や世界の現状、対策がわかるスライド資料↓
農林水産省消費・安全局 「抗生物質の使用と薬剤耐性菌の発生について−家畜用の抗生物質の見直し−」
「獣医療分野における抗菌剤の使用と
食用動物由来大腸菌の薬剤耐性との関連性に関する研究」(平成21年)
「食用動物における動物用抗菌薬の使用状況の調査結果について」(平成21年)
"豚でのマクロライド系等の使用の増加は、使用目的として呼吸器感染症( マクロライド系の効能・効果には肺炎が含まれる。) が増加していた"
"抗菌薬の使用目的は、牛及び豚では肺炎等の呼吸器感染症及び下痢が、産卵鶏ではコクシジウム症及び下痢が、肉用鶏ではコクシジウム症及び大腸菌症が多かった"
"経口投与は、非経口投与に比べて長期間、多数の動物に投与されることから、薬剤耐性菌の選択を最小限とするための抗菌薬使用のリスク管理においては、このことを踏まえた対応が必要であることが示唆された。"
餌にまぜるとして、どうやって適正量をとらせるのでしょうね?
動物だけでなく農作物にも使用されています。リンゴの木にアミカシンをシュッっとふりかけるなど、おどろきであります。
そして、余った餌とか、排泄された分(糞尿にまじった抗菌薬)が自然界に拡散します。風でとび、雨で流れます。
食糧となって国内各地、海外に広がります。
(ライリー先生によると、オーガニック野菜を食べている人たちは、そうでない人たちに比べて抗菌薬曝露量が多いそうです。がちょーん、です。)
なぜ、遠く離れたニューヨークと、カリフォルニアの膀胱炎の女子大生の尿から、まったく同じ遺伝子パターンの菌が出るのか?
このあたりでさまざまな仮説もたちます。
Antibiotic resistance of gram-negative enteric bacteria from pigs in three herds with different histories of antibiotic exposure.
Appl. Environ. Microbiol. September 1989 vol. 55 no. 9 2287-2292
恐ろしいのは耐性菌が広がることですが、細菌が耐性を獲得するメカニズムは、少しずつちがいます。
そのあたり、まだ整理できていないな〜という場合は、ぜひ臨床検査室の先生に講師をお願いして勉強会をしてもらうことをおすすめします。
Mechanisms of bacterial drug resistance--GPB
Gram positive bacteria
Penicillins (ß-lactamases)
Methicillins (mecA)
Vancomycin (vanA-C)
Macrolides (ErmB; MLS resistance plasmids)
Tetracycline (tetA)
Mechanisms of bacterial drug resistance--GNB
Aminoglycosides
minoglycoside acetyltransferases, adenyltransferases, phosphotransferases, efflux pumps, tRNA methylation
Beta-lactams
Molecular (Ambler) class A-D
Chloramphenicol
Chloramphenicol acetyltransferases
Fluoroquinolones
Pentapeptides family proteins; efflux pumps
Trimethoprim-sulfamethoxazole
Dihydrofolate reductase mutation
Molecular (Ambler) Class A-D ß-lactamases
A: TEM, SHV-1, CTX-M (Extended Spectrum Beta-Lactamases), KPC
B: metallo ß-lactamases (IMP, VIM, NDM-1)
C: AmpC
D: OXA, PSE
薬剤耐性のクレブシエラ肺炎桿菌(Kp)を例にみてみましょう。
ICUでおきるグラム陰性菌感染の15%を占めています。
カルパペネマー産生のKpが世界に広がっています。
カルバペネマーゼ産生菌では高い死亡率が確認されています(〜50%)
アウトブレイクを院内でおこします。
コリスチンに含め、薬剤耐性の菌が増えています。
Kpが院内で広がった時に、「まったく同じ菌が広がったのか?」また、「どのようなルートで広がったのか?」を調べる際にもモレキュラー、、、が活躍します。
このような話を聞きたい方はぜひ16日に国立感染症研究所の公開セミナーにご参加ください。
ライリー先生がやさしくかたります。
検査室関係の方にぜひご案内ください。
院内感染させた病院に落ち度があるんじゃね?的事件報道指向な語りには疑問大ですが、もしもこのことを社会の危機ととらえて抜本的な対策をするならば、「その病院」だけを問題視してもしょうがない背景があります。
メディアやジャーナリストのみなさん、ぜひ世界における問題の背景に切り込むような取材や社会提言をしていただければと期待しております。
(業界や製薬会社のバリアは強固かもしれませんが〜)
感染管理系の皆さんも、視野を院内だけではなく地域における耐性菌伝播、グローバルな耐性菌伝播の話に眼を向けていく必要があります。
ライリー先生の講義 Lecture10: Molecular Epidemiology of healthcare-associated infectionsから。
医療関連のサーベイランスには下記のようなものがあります。
米国:National Nosocomial Infection Surveillance System(NNIS)
Replaced in 2005 by National Health Safety Network(NHSN) 400病院の規模だそうです。
EU: Hospital in Europe Links for Infection Control SUrveillance(HELICS)
European Center for Disease Prevention and Control(ECDC)
日本:Japan Nosocomial Infection Surveillance(JANIS) じゃにす、ですね。
International: International Nosocomial Infection Control Consortium Surveillance(NINCC)
薬剤耐性のサーベイランス
EU European Antimicrobial Resistance Surveillance Network (EARS-Net)
米国 National Healthcare Safety Network (NHSN)
ヒトが移動をしますので、国を超えて同じ菌やウイルスが把握されたりもします。
「病院」で特に問題になる病原菌
-----------------------------------------
Gram-positive bacterial pathogens (3 genera)
Staphylococcus spp: MRSA, CA-MRSA, Coagulase-negative SA
Enterococcus spp: VRE
Clostridium difficile
Gram-negative bacterial pathogens (>10 genera)
Enterobacteriaceae
Glucose non-fermenters
Enterobacteriaceae
E. coli
Klebsiella pneumoniae
Proteus spp
Enterobacter spp
Serratia spp
Citrobacter spp
Morganella spp
Providentia spp
Salmonella spp
Glucose non-fermentors
Pseudomonas aeruginosa
Acinetobacter baumanii
Stenotrophomonas maltophilia
Fungal agents
Candida spp
Aspergillus spp
Diarrheagenic E. coli, especially enteropathogenic E. coli (EPEC)
Hepatitis B, C
HIV
Mycobacterium tuberculosis
SARS virus (coronavirus)
Clostridium difficile Associated with use of broad-spectrum antibiotics
グラム陽性/陰性での特徴をみてみます。
GPB
More common in hospital infections
Limited number of species
Limited number of drug-resistance mechanisms
More new drugs available to treat drug-resistant strains
GNB
Increasing prevalence in hospitals and healthcare settings
Many species
Many mechanisms of drug resistance
Absence of new drugs to treat drug-resistant strains
--------------------------------------
下記はシンガポールの National University Health System, Division of Infectious Diseasesからの発表。
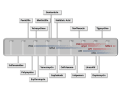
The Global Spread of Healthcare-Associated Multidrug-Resistant Bacteria: a Perspective from Asia.
Clin Infect Dis. 2013 Jan 18.
が、しかし。抗菌薬は「ヘルスケア関連」だけでつかわれているのではありません。
(話が横道にそれますが、横道といっていいのかはわかりません)
◆抗菌薬全体でみると、ヒトに使用されているのは総量の16%のみ
◆2010年、"29.1 million pounds"の抗菌薬のうち80%は食べ物関連で、17%は水に、3%は動物への注射として使用された
◆ノースカロライナの豚に使用された抗菌薬だけで、全米でヒトに使用された抗菌薬の使用量を上回る
日本や世界の現状、対策がわかるスライド資料↓
農林水産省消費・安全局 「抗生物質の使用と薬剤耐性菌の発生について−家畜用の抗生物質の見直し−」
「獣医療分野における抗菌剤の使用と
食用動物由来大腸菌の薬剤耐性との関連性に関する研究」(平成21年)
「食用動物における動物用抗菌薬の使用状況の調査結果について」(平成21年)
"豚でのマクロライド系等の使用の増加は、使用目的として呼吸器感染症( マクロライド系の効能・効果には肺炎が含まれる。) が増加していた"
"抗菌薬の使用目的は、牛及び豚では肺炎等の呼吸器感染症及び下痢が、産卵鶏ではコクシジウム症及び下痢が、肉用鶏ではコクシジウム症及び大腸菌症が多かった"
"経口投与は、非経口投与に比べて長期間、多数の動物に投与されることから、薬剤耐性菌の選択を最小限とするための抗菌薬使用のリスク管理においては、このことを踏まえた対応が必要であることが示唆された。"
餌にまぜるとして、どうやって適正量をとらせるのでしょうね?
動物だけでなく農作物にも使用されています。リンゴの木にアミカシンをシュッっとふりかけるなど、おどろきであります。
そして、余った餌とか、排泄された分(糞尿にまじった抗菌薬)が自然界に拡散します。風でとび、雨で流れます。
食糧となって国内各地、海外に広がります。
(ライリー先生によると、オーガニック野菜を食べている人たちは、そうでない人たちに比べて抗菌薬曝露量が多いそうです。がちょーん、です。)
なぜ、遠く離れたニューヨークと、カリフォルニアの膀胱炎の女子大生の尿から、まったく同じ遺伝子パターンの菌が出るのか?
このあたりでさまざまな仮説もたちます。
Antibiotic resistance of gram-negative enteric bacteria from pigs in three herds with different histories of antibiotic exposure.
Appl. Environ. Microbiol. September 1989 vol. 55 no. 9 2287-2292
恐ろしいのは耐性菌が広がることですが、細菌が耐性を獲得するメカニズムは、少しずつちがいます。
そのあたり、まだ整理できていないな〜という場合は、ぜひ臨床検査室の先生に講師をお願いして勉強会をしてもらうことをおすすめします。
Mechanisms of bacterial drug resistance--GPB
Gram positive bacteria
Penicillins (ß-lactamases)
Methicillins (mecA)
Vancomycin (vanA-C)
Macrolides (ErmB; MLS resistance plasmids)
Tetracycline (tetA)
Mechanisms of bacterial drug resistance--GNB
Aminoglycosides
minoglycoside acetyltransferases, adenyltransferases, phosphotransferases, efflux pumps, tRNA methylation
Beta-lactams
Molecular (Ambler) class A-D
Chloramphenicol
Chloramphenicol acetyltransferases
Fluoroquinolones
Pentapeptides family proteins; efflux pumps
Trimethoprim-sulfamethoxazole
Dihydrofolate reductase mutation
Molecular (Ambler) Class A-D ß-lactamases
A: TEM, SHV-1, CTX-M (Extended Spectrum Beta-Lactamases), KPC
B: metallo ß-lactamases (IMP, VIM, NDM-1)
C: AmpC
D: OXA, PSE
薬剤耐性のクレブシエラ肺炎桿菌(Kp)を例にみてみましょう。
ICUでおきるグラム陰性菌感染の15%を占めています。
カルパペネマー産生のKpが世界に広がっています。
カルバペネマーゼ産生菌では高い死亡率が確認されています(〜50%)
アウトブレイクを院内でおこします。
コリスチンに含め、薬剤耐性の菌が増えています。
Kpが院内で広がった時に、「まったく同じ菌が広がったのか?」また、「どのようなルートで広がったのか?」を調べる際にもモレキュラー、、、が活躍します。
このような話を聞きたい方はぜひ16日に国立感染症研究所の公開セミナーにご参加ください。
ライリー先生がやさしくかたります。
検査室関係の方にぜひご案内ください。